近日,放射医学与辐射防护国家重点实验室、放射医学与防护学院王广林团队与附属第二医院介入科靳勇团队在肝癌的联合治疗方面取得新进展,相关成果题为Dual Functional Radioactive Gel-Microspheres for Combinatorial Radioembolization and Photothermal Therapy of Hepatocellular Carcinoma的研究论文于3月3日在医疗材料杂志《Advanced Healthcare Material》上线上发表。论文链接:https://advanced.onlinelibrary.wiley.com/doi/full/10.1002/adhm.202401057
肝癌是威胁人类健康的重要原因之一,经动脉放射栓塞(Transarterial radiombolization,TARE)是临床中晚期肝细胞癌的一种有效治疗方法,将放射性微球递送至肿瘤血管诱导肿瘤细胞缺血坏死和DNA损伤达到肿瘤抑制的目的。放射性微球是TARE治疗使用的栓塞材料,但是市售用于栓塞的放射性微球密度大,不利于介入递送。且高辐射剂量会导致放射性肺炎、胃肠道反应等不良反应。因此,开发一种低密度可多功能协同治疗的微球有重大意义。
CalliSpheres®凝胶微球是通过共价键交联PVA骨架形成的。光滑的表面和完美的球形使其具有极佳的血管顺应性。70%的可变弹性可使微球顺利通过微导管,到达远端血管进行适形栓塞。此外,微球还具有良好的悬浮性和生物相容性,可悬浮在血液中而不易沉积。开发微球的其他特性,如成像性、装载化疗药物和放射性标记,可为患者的个性化治疗提供更多优势。本研究中,我们使用低密度商品化CalliSpheres®PVA凝胶微球包被聚多巴胺(PDA)作为放射性碘的载体,在近红外光照射下还可以将光能转化为热能,在肿瘤实现局部放射栓塞和光热的联合治疗。光热疗法利用热量破坏肿瘤细胞,而肿瘤细胞对热量比正常细胞更敏感,对正常细胞的副作用极小。此外,光热疗法可以重复进行,以消除残余肿瘤,降低复发的可能性。放射性核素和光敏材料与微球结合,通过动脉栓塞直接送达肿瘤部位。将光热疗法和TARE结合使用可显著降低治疗过程中的辐射剂量,并最大限度地减少对健康组织的损害,为肝癌的联合治疗提供了新思路。
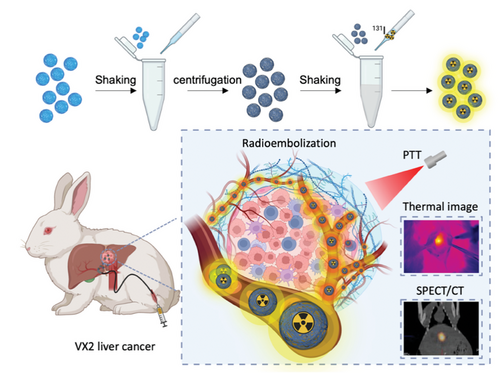
图一:131I放射性标记多巴胺修饰的PVA微球的制备示意图,用于HCC的TARE/PTT联合治疗
苏州大学是本论文的唯一作者单位,硕士孙婧和博士孙兴伟为共同第一作者,张于娟高级实验师、靳勇主任和王广林副教授为共同通讯作者。本研究得到国家自然科学基金、苏州大学苏州医学院基础前沿创新交叉科研项目、中国宝源投资有限公司研究项目、放射医学和辐射防护国家重点实验室科研创新项目,江苏省高等学校重点学科建设项目的支持。
(撰稿人孙婧、第一审稿人李志浩、审稿人王成奎 、第一校稿人董艺、第二校稿人王广林、校稿人徐加英)